Gli enzimi sono essenziali per il corretto funzionamento di tutti gli organismi viventi sulla Terra. Partecipano alla maggior parte, se non a tutti, i cambiamenti chimici in natura, cioè a milioni di reazioni sia nel mondo vegetale che in quello animale. Vale la pena scoprire cosa sono gli enzimi, come funzionano e qual è il loro significato per la medicina moderna.
Sommario
- Enzimi: struttura
- Regolazione dell'attività enzimatica
- Enzimi: ruolo
- Enzimi: nomenclatura
- Enzimi e medicine
- Malattie derivanti da enzimi disfunzionali
- Enzimi: uso diagnostico
- Enzimi e trattamento
Gli enzimi sono molecole proteiche che accelerano o addirittura permettono che varie reazioni chimiche abbiano luogo negli organismi viventi, compreso il corpo umano.
Da un punto di vista chimico si tratta di catalizzatori, cioè particelle che intensificano la reazione, ma non si consumano durante la reazione. Questo aumento dell'efficienza delle trasformazioni chimiche è spesso enorme, i catalizzatori naturali possono ridurre il tempo di reazione da diversi anni a diversi secondi.
Gli enzimi si trovano in tutte le aree del corpo: nelle cellule, nello spazio extracellulare, nei tessuti, negli organi e nella loro luce, ciò che catalizza un dato tessuto determina le sue proprietà specifiche e il ruolo che svolge nel corpo.
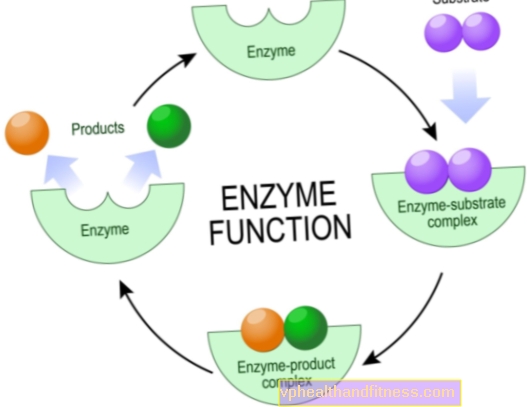
La maggior parte degli enzimi sono molto specifici, il che significa che ognuno di essi è responsabile di un solo tipo di reazione chimica in cui sono coinvolte particelle specifiche, i substrati, e solo loro possono interagire con un dato enzima.
L'attività dei catalizzatori naturali dipende da molti fattori: l'ambiente di reazione, ad es. Temperatura, pH, presenza di alcuni ioni, attivatori - potenziano l'azione di enzimi e inibitori che contrastano questa attività.
Enzimi: struttura
Come accennato, la maggior parte degli enzimi sono proteine, hanno una struttura molto diversa: da diverse dozzine di aminoacidi a diverse migliaia disposti in una struttura spaziale diversa.
È la forma della loro formazione (la cosiddetta struttura quaternaria) e il fatto che la maggior parte degli enzimi siano molto più grandi dei reagenti delle loro reazioni è in gran parte responsabile della loro attività.
Ciò è dovuto al fatto che solo una certa regione nella struttura degli enzimi è il cosiddetto sito attivo, cioè il frammento responsabile dell'esecuzione della reazione.
Il compito dei frammenti rimanenti della molecola è quello di attaccare un substrato specifico, meno spesso altri composti che influenzano l'attività dell'enzima.
Vale la pena sapere che la struttura del catalizzatore è progettata in modo che il substrato di giunzione sia idealmente adattato in termini di "chiave per la serratura".
Come tutte le proteine, gli enzimi sono prodotti nei ribosomi dal materiale genetico che è strettamente imballato nel nucleo - il DNA, creando così una cosiddetta struttura primaria.
Quindi si piega più volte, cambiando forma, a volte aggiungendo zuccheri, ioni metallici o residui di grasso.
Il risultato di tutti questi processi è la formazione di una struttura quaternaria attiva, cioè una forma completamente biologicamente attiva.
In molti casi, diverse particelle enzimatiche si combinano per eseguire una serie di reazioni chimiche e quindi accelerare il processo.
Succede che in più tessuti ci siano enzimi che catalizzano la stessa reazione, ma non sono strutturalmente simili tra loro, li chiamiamo isoenzimi.
I nomi degli isoenzimi sono gli stessi, nonostante la differenza di posizione e struttura, ma queste differenze hanno un'applicazione pratica. Pertanto, è possibile determinare nei test di laboratorio solo quelle frazioni enzimatiche che provengono da un organo specifico.
I meccanismi d'azione degli enzimi sono diversi, ma da un punto di vista chimico il loro compito è sempre quello di ridurre l'energia di attivazione della reazione. Questa è la quantità di energia che i substrati devono avere affinché il processo abbia luogo.
Questo effetto può essere ottenuto creando un ambiente appropriato per eseguire la reazione, utilizzando un percorso chimico diverso per ottenere gli stessi prodotti, o un'appropriata disposizione spaziale dei substrati.
Ciascuno di questi meccanismi può essere utilizzato dagli enzimi.
Regolazione dell'attività enzimatica
L'azione degli enzimi dipende dai parametri ambientali: temperatura, pH e altri. Ciascuno dei catalizzatori naturali ha le sue prestazioni ottimali in determinate condizioni, che possono essere ampiamente diverse a seconda della sua tolleranza alle condizioni ambientali.
Nel caso della temperatura, la maggior parte delle reazioni enzimatiche avvengono più velocemente a temperature più elevate, ma a una certa temperatura l'efficienza della reazione diminuisce drasticamente, il che è causato dal danno termico all'enzima (denaturazione).
In termini di struttura, gli ormoni possono essere suddivisi in due gruppi:
- semplice: queste sono solo particelle proteiche
- complesso - che richiede l'attaccamento di un gruppo non proteico - un cofattore alla loro attività
Questi ultimi svolgono un ruolo chiave nella corretta attività e regolazione degli enzimi.
A loro volta, i cofattori possono essere suddivisi in due gruppi: quelli necessari al funzionamento dell'enzima, fortemente associati ad esso - questi sono i cosiddetti gruppi protesici, possono essere metalli, molecole organiche, come, ad esempio, l'eme.
Il secondo gruppo sono i coenzimi, di solito sono responsabili del trasferimento di substrati o elettroni e il loro legame all'enzima è debole, questo gruppo comprende, ad esempio, acido folico, coenzima A. Vale la pena sapere che molte vitamine agiscono come cofattori.
Gli inibitori svolgono un compito completamente diverso, sono particelle che inibiscono l'attività enzimatica legandosi all'enzima.
Esistono diversi tipi di inibitori:
- irreversibili - provocano l'inattivazione permanente della molecola e la reazione può avvenire solo dopo la produzione di un nuovo enzima
- competitivo - in questo caso, l'inibitore ha una struttura simile al substrato, quindi competono per il sito attivo. Se è applicato un inibitore, la reazione fallisce fintanto che il substrato è normale
- non competitivo: tali inibitori legano l'enzima in un luogo diverso da quello in cui il substrato si attacca, quindi può attaccarsi all'enzima, ma la reazione non ha luogo
Ad una concentrazione del substrato molto superiore a quella dell'inibitore, l'effetto dell'inibitore competitivo viene superato perché supera la "competizione" per il sito attivo, in caso di non competitivo il suo effetto non può essere superato aumentando la concentrazione del substrato.
Oltre alla regolazione dei sistemi attivatore e inibitore, esistono molti altri metodi per controllare l'attività enzimatica.
Riguardano il controllo della produzione da parte della cellula a livello di formazione della proteina, nonché la regolazione del cosiddetto trattamento post-traduzionale, cioè i cambiamenti nella struttura di una molecola proteica che si verificano immediatamente dopo la sua sintesi nel ribosoma. Queste modifiche stanno, ad esempio, accorciando la catena polipeptidica.
Altri metodi di regolazione riguardano la segregazione e il posizionamento degli enzimi in aree appropriate: cellulari e in specifici organelli, o nel compartimento extracellulare.
C'è un altro importante meccanismo di regolazione - feedback negativo - è il sistema di controllo principale nel sistema endocrino. Funziona sul principio dell'inibizione.
Ciò significa che se un enzima produce una quantità eccessiva di un certo ormone, si lega ad esso, inibendone l'attività e riducendone la sintesi, quindi il prodotto di reazione stesso ne inibisce la produzione.
Enzimi: ruolo
Ogni tessuto del corpo umano produce un insieme specifico di enzimi, che definisce il ruolo di queste cellule nel funzionamento del corpo. Cosa sono questi enzimi è definito dal codice genetico e quali regioni sono attive in una data cellula.
Migliaia di reazioni chimiche avvengono nel corpo umano in qualsiasi momento, ognuna delle quali richiede un enzima specifico, quindi sarebbe difficile elencare tutte queste particelle presenti nel nostro corpo.
Tuttavia, vale la pena conoscere alcuni dei più caratteristici:
- Enzimi digestivi - prodotti dai tessuti dell'apparato digerente, scompongono il cibo in composti semplici, perché solo questi possono essere assorbiti nel sangue. Sono enzimi extracellulari, quindi svolgono il loro compito principale al di fuori delle cellule in cui vengono prodotti. Alcuni di questi enzimi si formano in una forma inattiva, i cosiddetti proenzimi o zimogeni, e vengono attivati nel tratto gastrointestinale. Gli enzimi digestivi includono ad esempio amilasi, lipasi, tripsina.
- La miosina è un enzima presente nei muscoli, scompone le molecole di ATP portatrici di energia, grazie alle quali provoca la contrazione delle fibre muscolari.
- Le perossidasi sono enzimi ossidanti e catalasi, cioè enzimi riducenti
- L'acetilcolinesterasi è un enzima che scompone l'acetilcolina, uno dei messaggeri nel sistema nervoso
- La monoamino ossidasi è l'enzima più abbondante nel fegato ed è responsabile della ripartizione di adrenalina, norepinefrina e alcuni farmaci
- Citocoma ossidasi, un enzima intracellulare molto importante responsabile dei cambiamenti energetici
- Il lisozima, una sostanza presente ad esempio nelle lacrime o nella saliva che svolge funzioni protettive, distrugge i patogeni
- Alcol deidrogenasi, un enzima nel fegato responsabile della scomposizione dell'etanolo
- Fosfatasi alcalina, partecipa alla costruzione ossea da parte degli osteoblasti
Enzimi: nomenclatura
I nomi degli enzimi sono spesso piuttosto complicati in quanto derivano dal nome della reazione che effettuano e dal substrato coinvolto nella reazione, ad esempio 5-idrossitriptofano decarbossilasi.
Tipicamente, il suffisso "-aza" viene aggiunto al nome generico di una reazione e la seconda parte del nome dell'enzima forma il nome del composto che subisce questa reazione.
Succede che il nome sia singolo, quindi deriva da un substrato, ad esempio la lattasi (enzima che scompone il lattosio).
Più raramente, i nomi degli enzimi derivano da un processo generale che avviene con la loro partecipazione, ad esempio la DNA girasi, cioè l'enzima responsabile della rotazione dei filamenti di DNA.
Alcuni enzimi alla fine hanno nomi comuni, o quelli dati dal loro scopritore, come la pepsina (che scompone le proteine nel tratto digerente) o il lisozima (un enzima battericida contenuto nelle lacrime).
Esiste anche un piccolo gruppo di enzimi di restrizione responsabili del taglio dei filamenti di DNA, in questo caso il nome deriva dal microrganismo da cui è stato isolato l'enzima.
L'Unione Internazionale di Biochimica e Biologia Molecolare ha introdotto le regole per la denominazione degli enzimi e le ha suddivise in diverse classi al fine di standardizzare la nomenclatura.
Non ha sostituito i nomi descritti in precedenza, è piuttosto un integratore utilizzato principalmente dagli scienziati.
Secondo le regole dell'Unione Europea, ogni enzima è descritto da una sequenza di caratteri: EC x.xx.xx.xx - dove la prima cifra rappresenta la classe, le successive sottoclassi e sottoclassi e infine il numero dell'enzima. Le classi di enzimi menzionate sono:
• 1 - ossidoreduttasi: catalizza le reazioni di ossidazione e riduzione
• 2 - transferasi: trasferimento di gruppi funzionali (es. Fosfato)
• 3 - idrolasi: corrispondono all'idrolisi (decomposizione) dei legami
• 4 - liasi: rompono i legami con un meccanismo diverso dall'idrolisi
• 5 - isomerasi: sono responsabili dei cambiamenti spaziali delle molecole
• 6 - ligasi: connettono molecole con legami covalenti
Enzimi e medicine
L'importanza degli enzimi per la salute umana è enorme. Il loro corretto funzionamento consente una vita sana e, grazie allo sviluppo di dispositivi analitici, abbiamo imparato a diagnosticare varie malattie mediante determinazione enzimatica. Inoltre, siamo in grado di trattare con successo le carenze di alcuni enzimi e le malattie che ne derivano, ma purtroppo c'è ancora molto da fare in questa materia.
Il trattamento delle cause delle malattie metaboliche non è ancora possibile, perché non siamo in grado di modificare in modo sicuro ed efficace il materiale genetico per riparare i geni danneggiati e quindi gli enzimi prodotti in modo improprio.
Malattie derivanti da enzimi disfunzionali
Il corretto funzionamento del nostro corpo dipende in gran parte dal corretto funzionamento degli enzimi. In molti casi, gli stati di malattia influenzano la quantità di enzimi, provocandone un rilascio eccessivo dalle cellule o, al contrario, una carenza.I seguenti sono solo esempi di malattie causate da funzioni enzimatiche anormali, ce ne sono molte di più.
- Blocchi metabolici o malattie metaboliche
I blocchi metabolici o malattie metaboliche sono un gruppo di malattie ereditarie causate dall'accumulo di sostanze nella cellula a causa della mancanza di un enzima responsabile del loro metabolismo. I substrati accumulati nel tempo sono talmente tanti da diventare tossici per le cellule e per l'intero organismo.
Esistono diverse migliaia di queste malattie, il loro numero riflette la moltitudine di enzimi presenti nel corpo umano, poiché le malattie metaboliche possono influenzare la maggior parte dei geni che codificano gli enzimi.
Esempi sono la galattosemia o l'omocistinuria, che sono malattie rare, che si manifestano molto spesso subito dopo la nascita o nei primi anni di vita.
- Tumori
Un altro gruppo di malattie in cui può essere coinvolto il malfunzionamento degli enzimi è il cancro. Oltre a molte altre funzioni, gli enzimi sono anche responsabili della regolazione della divisione cellulare, le cosiddette tirosin chinasi. Se questi enzimi falliscono in quest'area, può verificarsi una divisione cellulare incontrollata e quindi un processo neoplastico.
- Enfisema
Una malattia meno comune è l'enfisema, nel qual caso l'elastasi diventa iperattiva. È un enzima presente nel tessuto polmonare responsabile, tra l'altro, della scomposizione della proteina elastina presente nei polmoni.
Se è troppo attivo, l'equilibrio tra distruzione e costruzione è disturbato, si formano cicatrici e si sviluppa l'enfisema.
Enzimi: uso diagnostico
La diagnostica medica moderna si basa sull'uso di enzimi nelle loro determinazioni. Ciò è dovuto al fatto che gli stati di malattia portano direttamente o indirettamente a uno squilibrio degli enzimi, provocando aumenti o diminuzioni della loro quantità nel sangue.
Ciò può derivare non solo da disturbi della produzione, ma anche, ad esempio, dal rilascio di una grande quantità di enzima intracellulare nel sangue o nelle urine a seguito di danni alla membrana cellulare.
Esempi di enzimi utilizzati nei test di laboratorio sono:
- Creatina chinasi - un enzima presente nei muscoli, anche nel muscolo cardiaco, il suo aumento multiplo può indicare un infarto, miocardite, malattie muscolari - lesioni, distrofia.
- Lattato deidrogenasi - presente in tutte le cellule del corpo, specialmente nel cervello, nei polmoni, nei globuli bianchi e nei muscoli. Il suo grande aumento si osserva in attacchi di cuore, malattie muscolari e epatiche o cancro.
- La fosfatasi alcalina si trova principalmente nel fegato e nelle ossa, qui viene rilasciata dagli osteoblasti. Le malattie di questi organi possono causare la sua crescita, ma l'eccesso di fosfatasi alcalina può anche indicare il processo di rigenerazione delle ossa - dopo un intervento chirurgico o una frattura.
- La fosfatasi acida è presente in molti organi - fegato, reni, ossa, prostata, dal punto di vista diagnostico il suo aumento può indicare malattie delle ossa e della prostata.
- Aspartato aminotransferasi e alanina aminotransferasi - questi sono enzimi caratteristici del fegato, presenti quasi esclusivamente negli epatociti, sono utilizzati nella diagnosi di screening di base delle malattie del fegato e il loro aumento di diverse volte nei loro valori richiede sempre un'ulteriore diagnosi delle malattie del fegato.
- Glutammato deidrogenasi e gammaglutamiltransferasi - altri enzimi epatici, simili a quelli precedentemente menzionati, sono importanti nella diagnosi delle malattie di questo organo e dei dotti biliari.
- L'amilasi è un enzima presente in molti organi, ma la massima concentrazione si raggiunge nelle cellule del pancreas e delle ghiandole salivari, la sua diagnosi è della massima importanza nelle loro malattie.
- La lipasi è un altro enzima pancreatico, differisce in specificità dall'amilasi, il che significa che la lipasi si verifica solo nel pancreas e le deviazioni dalla norma nella determinazione di questo enzima indicano una malattia pancreatica.
- La colinesterasi è un enzima che scompone l'acetilcolina - un trasmettitore nel sistema nervoso, dove è anche presente in quantità maggiore, nella diagnostica viene utilizzato nell'avvelenamento con composti organofosforici.
- Fattori di coagulazione e fibrinolisi: si tratta di sostanze prodotte dal fegato coinvolte nella coagulazione del sangue, le loro determinazioni sono importanti non solo nella valutazione di questo processo, ma anche nel monitoraggio della funzionalità epatica.
- Alfa-fetoproteina - un enzima epatico, la cui quantità aumenta nelle malattie di questo organo, incluso il cancro.
- Proteina C-reattiva - prodotta dal fegato, che prende parte alla risposta immunitaria, la sua quantità aumenta nel sangue in condizioni infiammatorie - infezioni, lesioni, malattie autoimmuni.
- Ceruloplasmina - un altro enzima epatico, il cui aumento è caratteristico della malattia di Wilson.
- La piridinolina e la deossipiridinolina sono marker di riassorbimento (distruzione) osseo e caratterizzano la funzione degli osteoclasti (cellule osteogeniche).
- Mioglobina: come accennato in precedenza, questo è un composto caratteristico dei muscoli, quindi il suo aumento indicherà un danno ai muscoli scheletrici o cardiaci.
- Le troponine - i cosiddetti marker di infarto, sono enzimi che regolano la contrazione delle fibre muscolari, sono particolarmente abbondanti nel muscolo cardiaco. Il suo danno provoca il rilascio di grandi quantità di troponine nel sangue, che viene utilizzato nella diagnosi delle malattie cardiache. Vale la pena ricordare, tuttavia, che un aumento delle troponine può indicare non solo un infarto, ma anche una sua insufficienza, difetti valvolari o embolia polmonare.
Tutti gli enzimi sopra elencati possono essere classificati in diversi gruppi:
- Enzimi secretori: il limite inferiore della norma è diagnostico. Sono enzimi fisiologicamente prodotti dagli organi, ma in caso di malattie il loro numero diminuisce, ad es. Fattori di coagulazione
- Enzimi indicatori: la crescita è importante. Questo gruppo di enzimi appare in gran numero a causa di danni agli organi e perdite di enzimi, includono ad esempio le troponine
- enzimi escretori - questi sono enzimi prodotti normalmente nel lume di vari organi - la bocca, l'intestino e il tratto urinario. Se la loro uscita è bloccata, entrano nel sangue, ad es. Amilasi
Vale la pena ricordare che gli enzimi sono utilizzati nella diagnostica medica stessa. Le analisi biochimiche vengono eseguite con l'uso di enzimi e un'appropriata interpretazione dei risultati delle reazioni enzimatiche consente di fornire il risultato di un test di laboratorio.
Enzimi e trattamento
Molti farmaci agiscono influenzando l'azione degli enzimi, inducendoli ad agire o, al contrario, essendo inibitori. Esistono sostituti enzimatici come la pancreatina contenente lipasi e amilasi per l'insufficienza pancreatica.
D'altra parte, alcuni gruppi di farmaci inibiscono l'azione degli enzimi, ad es. Inibitori dell'enzima di conversione dell'angiotensina utilizzati, tra gli altri, nell'ipertensione e nell'insufficienza cardiaca, o alcuni antibiotici, ad es. Amoxicillina, che inibisce l'enzima transpeptidasi batterica, che impedisce la costruzione della parete cellulare batterica e quindi inibisce infezione.
Alcuni veleni agiscono anche influenzando gli enzimi. Il cianuro è un potente inibitore della citocromo ossidasi, un componente essenziale della catena respiratoria. Bloccarlo impedisce alla cellula di ottenere energia, che porta alla sua morte.
Per il corretto svolgimento dei processi vitali delle cellule, è necessaria la presenza di molte sostanze chimiche, che rimangono in strette proporzioni tra di loro e tra le quali avvengono costantemente reazioni chimiche.
Questo compito viene svolto da enzimi correttamente funzionanti, necessari affinché quasi tutte le reazioni chimiche abbiano luogo con la velocità e l'efficienza necessarie per il corretto funzionamento del corpo umano.
L'azione degli enzimi accelera questi processi molte volte, spesso anche centinaia di volte, il che è importante, gli enzimi stessi non si consumano durante le reazioni che avvengono.
La mancanza di catalizzatori o il loro funzionamento inadeguato può provocare l'insorgenza di molte malattie. D'altra parte, la modifica abile della loro attività ti consente di trattare con successo molti disturbi.
L'enzimologia (la scienza degli enzimi) è estremamente ampia e il suo sviluppo può portare non solo progressi scientifici, ma anche contribuire attivamente allo sviluppo della medicina in termini non solo di trattamento, ma anche di diagnostica.
Circa l'autore




.jpg)













---makulopatia-cukrzycowa.jpg)


---przyczyny-objawem-jakiej-choroby-jest-wielomocz.jpg)
