1 flaconcino (1,5 ml) di concentrato contiene 60 mg di cabazitaxel. Dopo la diluizione iniziale con l'intero volume del solvente, 1 ml della soluzione contiene 10 mg di cabazitaxel. Il flaconcino di solvente contiene 573,3 mg di etanolo al 96%.
| Nome | Contenuto della confezione | Il principio attivo | Prezzo 100% | Ultima modifica |
| Jevtan | 1 flaconcino da 1,5 ml finale + 1 flaconcino da 4,5 ml ricostituito, finale e ricostituito per la preparazione soluzione a inf. | Cabazitaxel | 2019-04-05 |
Azione
Farmaco antitumorale. Agisce interrompendo la rete dei microtubuli nelle cellule, si lega alla tubulina e stimola la deposizione della tubulina nei microtubuli, inibendone la degradazione. Porta alla stabilizzazione dei microtubuli, che inibisce la divisione cellulare mitotica e interfase. Cabazitaxel mostra un ampio spettro di attività antitumorale contro tumori umani avanzati nei topi impiantati. È attivo contro le neoplasie sensibili al docetaxel e non suscettibili alla chemioterapia contenente docetaxel. Viene metabolizzato nel fegato (> 95%), principalmente tramite l'isoenzima CYP3A4 (80-90%). Viene escreto principalmente nelle feci sotto forma di numerosi metaboliti (76% della dose; l'escrezione renale rappresenta meno del 4% della dose). Si lega alle proteine del siero nell'89-92%. T0.5 nella fase di eliminazione è 95h.
Dosaggio
Per via endovenosa. Adulti. Il farmaco deve essere utilizzato solo in unità specializzate nella somministrazione di farmaci citotossici e deve essere somministrato solo sotto la supervisione di un medico qualificato nell'uso della chemioterapia antitumorale.Al fine di ridurre il rischio e l'aggravamento delle reazioni di ipersensibilità, il regime di premedicazione raccomandato deve essere eseguito almeno 30 minuti prima di ogni somministrazione del farmaco mediante somministrazione endovenosa dei seguenti preparati: antistaminico (5 mg di dexchlorphenyramine o 25 mg di difenidramina o un farmaco di potenza equivalente), corticosteroide (8 mg di desametasone o un farmaco con potenza equivalente) e un antagonista del recettore H2 (ranitidina o un farmaco con potenza equivalente). Si raccomanda di utilizzare antiemetici profilattici, che possono essere somministrati per via orale o endovenosa secondo necessità. I pazienti devono essere adeguatamente idratati durante il trattamento. La dose raccomandata è di 25 mg / m2. somministrato come infusione endovenosa di 1 ora ogni 3 settimane, in combinazione con prednisone orale o prednisolone 10 mg somministrato giornalmente durante il trattamento. La dose deve essere aggiustata se i pazienti sviluppano le seguenti reazioni avverse: Neutropenia di grado ≥3 a lungo termine (superiore a 1 settimana) nonostante un trattamento appropriato, incluso G-CSF - il trattamento deve essere ritardato fino a quando la conta dei neutrofili non è> 1.500 cellule / mm3 e quindi ridurre la dose di cabazitaxel da 25 mg / m2. fino a 20 mg / m2 di superficie corporea; Neutropenia febbrile o infezione neutropenica: il trattamento deve essere ritardato fino a quando i sintomi migliorano o si risolvono e una conta dei neutrofili è> 1.500 cellule / mm3, quindi ridurre la dose di cabazitaxel da 25 mg / m2. fino a 20 mg / m2 di superficie corporea; Diarrea di grado ≥3. o diarrea che persiste nonostante un trattamento appropriato, compresa la sostituzione di liquidi ed elettroliti - il trattamento deve essere ritardato fino a quando i sintomi migliorano o si risolvono, quindi ridurre la dose di cabazitaxel da 25 mg / m2. fino a 20 mg / m2 di superficie corporea; Neuropatia periferica di grado> 2 - il trattamento deve essere ritardato fino al miglioramento, quindi ridurre la dose di cabazitaxel da 25 mg / m2. fino a 20 mg / m2 Il trattamento deve essere interrotto se il paziente continua a manifestare uno qualsiasi degli effetti indesiderati descritti alla dose di 20 mg / m2. Gruppi speciali di pazienti. Nei pazienti con compromissione epatica lieve (bilirubina totale da> 1 a ≤ 1,5 limite superiore della norma (ULN) o AST> 1,5 x ULN), la dose di cabazitaxel deve essere ridotta a 20 mg / m2. Deve essere prestata cautela e la sicurezza di cabazitaxel somministrata in pazienti con lieve compromissione epatica. In pazienti con insufficienza epatica moderata (bilirubina totale da> 1,5 a ≤ 3 x ULN), la dose massima tollerata è di 15 mg / m2. Quando si trattano pazienti con compromissione epatica moderata, la dose di cabazitaxel non deve superare i 15 mg / m2. Cabazitaxel non deve essere somministrato a pazienti con grave insufficienza epatica (bilirubina totale> 3 x ULN). Non è richiesto alcun aggiustamento della dose nei pazienti con insufficienza renale che non richiedono emodialisi. Per i pazienti con malattia renale allo stadio terminale (clearance della creatinina (metodo di somministrazione CLCR) le sacche per infusione in PVC e i set per infusione in poliuretano non devono essere utilizzati.
Indicazioni
Il farmaco in combinazione con prednisone o prednisolone è indicato per il trattamento di pazienti con carcinoma prostatico metastatico ormone refrattario precedentemente trattati con un regime chemioterapico contenente docetaxel.
Controindicazioni
Ipersensibilità al cabazitaxel, altri taxani o ad uno qualsiasi degli eccipienti, incluso il polisorbato 80. Conta dei neutrofili inferiore a 1500 / mm3. Compromissione epatica (bilirubina totale ≥ 3 x ULN). Vaccinazione concomitante con vaccino contro la febbre gialla.
Precauzioni
Tutti i pazienti devono ricevere una premedicazione prima di iniziare un'infusione di cabazitaxel. I pazienti devono essere monitorati per la comparsa di reazioni di ipersensibilità (specialmente durante la 1a e 2a infusione; possono verificarsi gravi reazioni di ipersensibilità - eruzione cutanea generalizzata, eritema, ipotensione, broncospasmo); in caso di reazione di ipersensibilità, interrompere l'uso del farmaco. I pazienti trattati con cabazitaxel possono ricevere G-CSF profilattico secondo le raccomandazioni dell'American Society of Clinical Oncology e / o le attuali linee guida del centro per ridurre il rischio o gestire le complicanze della neutropenia. La profilassi primaria con G-CSF deve essere presa in considerazione nei pazienti con caratteristiche cliniche ad alto rischio (età> 65 anni, cattivo stato funzionale, precedenti episodi di neutropenia febbrile, vaste aree del corpo precedentemente irradiate, cattivo stato nutrizionale o altre gravi comorbidità) che predispongono per aumentare le complicanze della neutropenia prolungata. È stato dimostrato che l'uso di G-CSF riduce l'incidenza e la gravità della neutropenia. L'emocromo completo deve essere eseguito ogni settimana durante il ciclo di trattamento 1 e prima di ogni ciclo successivo in modo che la dose possa essere regolata se necessario. La dose deve essere ridotta in caso di neutropenia febbrile o neutropenia prolungata nonostante un trattamento appropriato. I pazienti devono essere nuovamente trattati dopo che la loro conta dei neutrofili ritorna a ≥ 1.500 / mm3. Sintomi come dolore e sensibilità addominale, febbre, costipazione persistente, diarrea con o senza neutropenia possono essere segni precoci di grave tossicità gastrointestinale, che deve essere prontamente valutata e trattata, e la terapia con cabazitaxel può dover essere ritardata o interrotta. Se i pazienti sviluppano diarrea, possono essere trattati con farmaci antidiarroici comunemente usati. I pazienti che hanno ricevuto in precedenza irradiazione nella zona addominale e pelvica sono a maggior rischio di diarrea. La disidratazione è più comune nei pazienti di età ≥ 65 anni. Devono essere intraprese azioni per reidratare il paziente e per monitorare e correggere gli elettroliti sierici, in particolare il potassio. Con diarrea di grado ≥3. potrebbe essere necessario posticipare il trattamento o ridurre la dose. Se i pazienti manifestano nausea o vomito, possono essere trattati con antiemetici comunemente usati. Emorragia gastrointestinale e perforazione gastrointestinale, ileo paralitico, colite, inclusa colite fatale sono stati segnalati in pazienti trattati con cabazitaxel Si raccomanda cautela nel trattamento di pazienti a più alto rischio di complicanze gastrointestinali: in pazienti con neutropenia, anziani età, uso concomitante di farmaci antinfiammatori non steroidei, terapia antipiastrinica, terapia anticoagulante, in pazienti con precedente radioterapia pelvica o in pazienti con malattie gastrointestinali come ulcerazione gastrointestinale e sanguinamento. La presenza o il peggioramento della neuropatia deve essere valutata prima di qualsiasi trattamento; il trattamento deve essere ritardato fino al miglioramento dei sintomi e in caso di neuropatia periferica persistente di grado> 2. ridurre la dose. La creatinina sierica deve essere misurata prima dell'inizio della terapia, durante tutti i test emocromocitometrici e ogni volta che un paziente segnala una variazione del volume delle urine. Il farmaco deve essere sospeso in caso di insufficienza renale di grado CTCAE 4.0 ≥3. Si deve usare cautela nei pazienti anziani (≥ 65 anni di età) a causa di un aumentato rischio di reazioni avverse incluse neutropenia e neutropenia febbrile e in pazienti con un livello di emoglobina di 3 x ULN). La dose deve essere ridotta nei pazienti con compromissione epatica lieve (bilirubina totale da> 1 a ≤1,5 x ULN o AST> 1,5 x ULN). L'uso concomitante di potenti inibitori del CYP3A deve essere evitato in quanto possono aumentare la concentrazione plasmatica di cabazitaxel. L'uso concomitante di potenti induttori del CYP3A4 deve essere evitato in quanto possono ridurre le concentrazioni plasmatiche di cabazitaxel. Il solvente contiene 573,3 mg di etanolo al 96% (15% v / v), che corrisponde a 14 ml di birra o 6 ml di vino - questo dovrebbe essere preso in considerazione nelle persone che soffrono di alcolismo e pazienti con malattie del fegato o epilessia.
Attività indesiderabile
Effetti collaterali e disturbi ematologici in pazienti che ricevono il preparato in combinazione con prednisone o prednisolone. Molto comune: neutropenia, anemia, leucopenia, trombocitopenia, anoressia, disgeusia, dispnea, tosse, diarrea, nausea, vomito, costipazione, dolore addominale, alopecia, mal di schiena, artralgia, ematuria, affaticamento, astenia, febbre. Comune: shock settico, sepsi, cellulite, infezione del tratto urinario, influenza, cistite, infezione del tratto respiratorio superiore, fuoco di Sant'Antonio, micosi, neutropenia febbrile, ipersensibilità, disidratazione, iperglicemia, ipokaliemia, ansia, stato confusionale, neuropatia periferica, neuropatia sensoriale, capogiri, cefalea, parestesia, letargia, ipoestesia, sciatica, congiuntivite, aumento della lacrimazione, tinnito, vertigini, fibrillazione atriale, tachicardia, ipotensione, trombosi venosa profonda, ipotensione ortostatica, vampate di calore, arrossamento parossistico della pelle, dolore orofaringeo, polmonite, indigestione, dolore addominale superiore, emorroidi, malattia da reflusso gastroesofageo, sanguinamento rettale, bocca secca, flatulenza, pelle secca, eritema, dolore alle estremità, spasmo muscolare , dolore muscolare, dolore toracico muscoloscheletrico elet dolore, dolore laterale del corpo, insufficienza renale acuta, insufficienza renale, difficoltà a urinare, colica renale, pollachiuria, idronefrosi, ritenzione urinaria, incontinenza urinaria, ostruzione ureterale, dolore pelvico, edema periferico, mucosite, dolore, dolore toracico gonfiore, brividi, malessere, perdita di peso, aumento dell'AST, aumento delle aminotransferasi. In uno studio clinico, il 18,3% dei pazienti ha interrotto il trattamento a causa di effetti collaterali; la reazione avversa più comune che ha portato all'interruzione del trattamento è stata la neutropenia (2,4%). Incidenza di neutropenia di grado ≥3. sulla base dei risultati dei test di laboratorio, era dell'81,7%. L'incidenza della neutropenia clinica e della neutropenia febbrile di Grado ≥3 è stata rispettivamente del 21,3% e del 7,5%. Le complicanze neutropeniche includevano infezione neutropenica, sepsi neutropenica e shock settico, in alcuni casi con esito fatale. L'incidenza di anemia di Grado ≥3, AST, ALT e bilirubina è aumentata dai risultati di laboratorio, rispettivamente, del 10,6%, 0,7%, 0,9% e 0,6%. Le seguenti reazioni avverse, con una frequenza ≥5%, sono state riportate più frequentemente nei pazienti di età ≥65 anni rispetto ai pazienti più giovani: affaticamento, neutropenia clinica, astenia, piressia, capogiri, infezioni del tratto urinario e disidratazione. La frequenza delle seguenti reazioni avverse di grado ≥3. era maggiore nei pazienti di età ≥65 anni rispetto ai pazienti più giovani: neutropenia di laboratorio, neutropenia clinica e neutropenia febbrile.
Gravidanza e allattamento
Non sono disponibili dati sull'uso di cabazitaxel nelle donne in gravidanza. Studi su animali hanno mostrato tossicità riproduttiva a dosi maternotossiche e la penetrazione di cabazitaxel attraverso la barriera placentare, pertanto cabazitaxel può danneggiare il feto in donne in gravidanza esposte - non usare il farmaco durante la gravidanza e in donne in età fertile che non usano misure contraccettive efficaci. Il farmaco non deve essere utilizzato durante l'allattamento. Non è possibile escludere un effetto di cabazitaxel sulla fertilità maschile, pertanto durante il trattamento e fino a 6 mesi dopo l'ultima dose deve essere utilizzata una contraccezione efficace. I pazienti di sesso maschile che ricevono cabazitaxel devono prevenire il contatto di altre persone con il loro eiaculato durante il trattamento e devono considerare la conservazione dello sperma prima dell'inizio del trattamento.
Commenti
Il farmaco può influire sulla capacità di guidare o di usare macchinari poiché provoca stanchezza e vertigini. I pazienti devono essere istruiti a non guidare o utilizzare macchinari se manifestano questi effetti indesiderati durante il trattamento.
Interazioni
Studi in vitro hanno dimostrato che cabazitaxel è metabolizzato principalmente da CYP3A e inibisce. L'uso concomitante di potenti inibitori del CYP3A (ad es. Ketoconazolo, itraconazolo, claritromicina, atazanavir, indinavir, nefazodone, nelfinavir, ritonavir, saquinavir, telitromicina, voriconazolo) presumibilmente aumenta la concentrazione di cabazitaxel e deve essere evitato in associazione con cautela Inibitori del CYP3A. È probabile che l'uso concomitante di potenti induttori del CYP3A (ad es. Fenitoina, carbamazepina, rifampicina, rifabutina, rifapentina, fenobarbital) riduca le concentrazioni di cabazitaxel - deve essere evitato l'uso concomitante di potenti induttori del CYP3A. I pazienti non devono assumere preparati contenenti erba di San Giovanni. È stato anche dimostrato che cabazitaxel inibisce il gruppo polipeptidico OATP1B1 che trasporta gli anioni organici. Il rischio di interazione con i substrati di OATP1B1 (ad es. Statine, valsartan, repaglinide) è possibile, specialmente durante il tempo di infusione (1 ora) e fino a 20 minuti. dopo la fine dell'infusione. Si raccomanda un intervallo di 12 ore prima dell'infusione e almeno 3 ore dopo l'infusione prima della somministrazione del substrato OATP1B1. La vaccinazione con un vaccino vivo attenuato deve essere evitata nei pazienti che ricevono cabazitaxel. È possibile utilizzare vaccini morti o inattivati, ma la risposta a tali vaccini può essere ridotta.
Il preparato contiene la sostanza: Cabazitaxel
Droga rimborsata: NO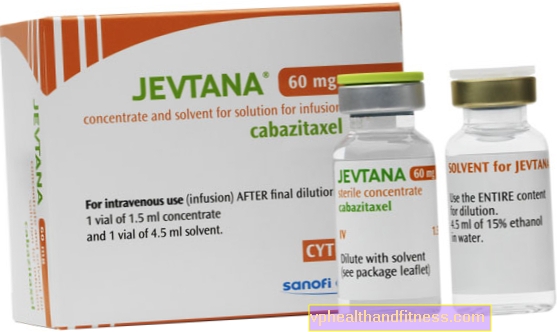

















-czyli-pograniczne-zaburzenie-osobowoci.jpg)

